アンモニア 燃やす 化学式 159030-アンモニア 燃やす 化学式
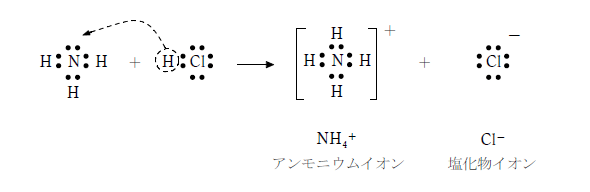
無機化学 第16回 水素 窒素 医学部受験を決めたら 私立 国公立大学医学部に入ろう ドットコム
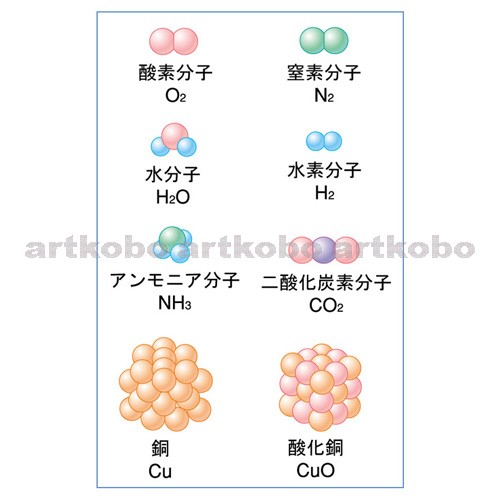
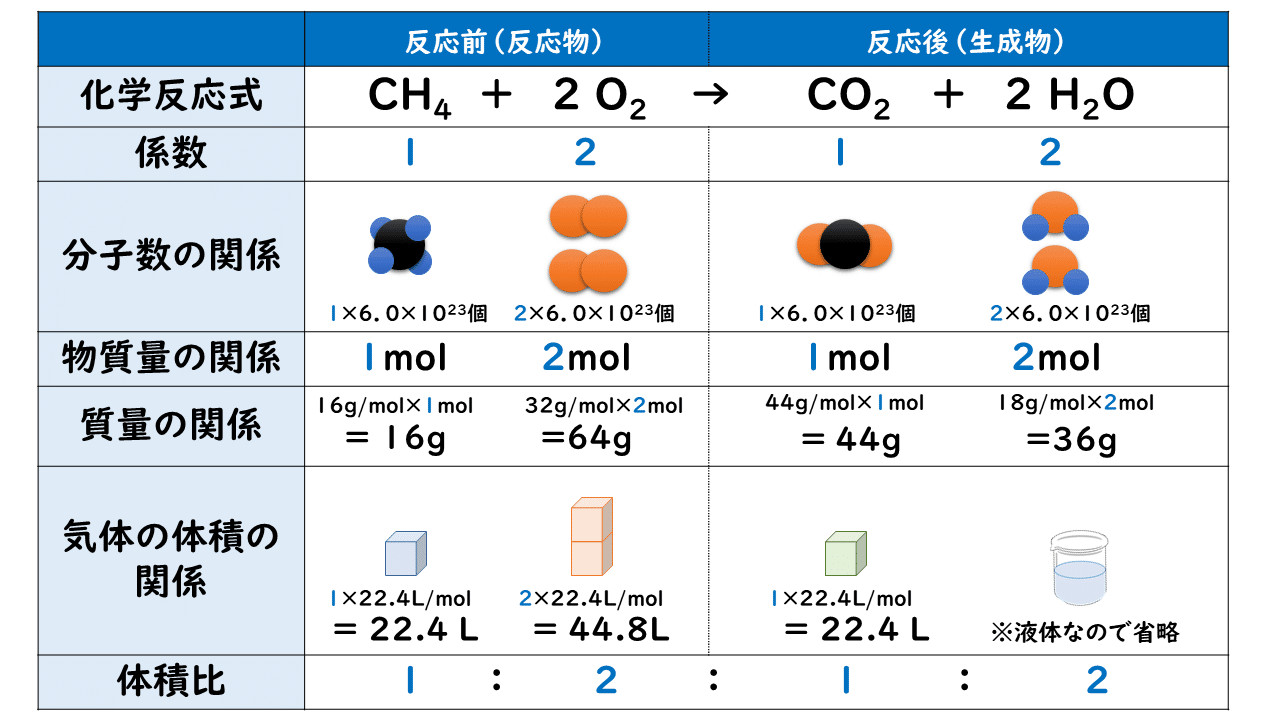
アンモニアを燃焼させたときの化学式は以下。 2nh3 15o2 → n2 3h2o たしかにこの化学式だけ見ればアンモニアはco2を排出しない魔法のような燃料だと言えます。 ところがそう単純でもないのです。そもそもアンモニアを作ること自体にたくさんの 本研究では、微粉炭とアンモニアの混焼の基礎的な物理現象を明らかにするための燃焼観察場として、光学計測に適し流速が遅い大気開放の層流対向流バーナ( 図1 、 図2 参照)を用いた"層流対向流場 "を採用しました。 その層流対向流バーナで燃焼する微粉炭に対して、高い時間・空間
アンモニア 燃やす 化学式
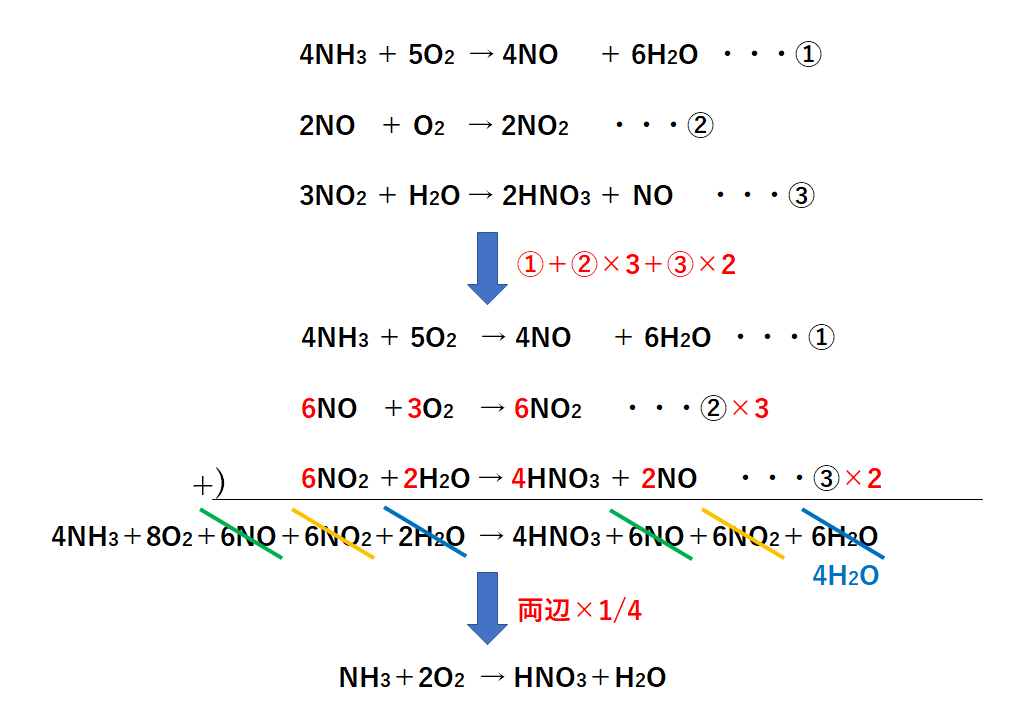
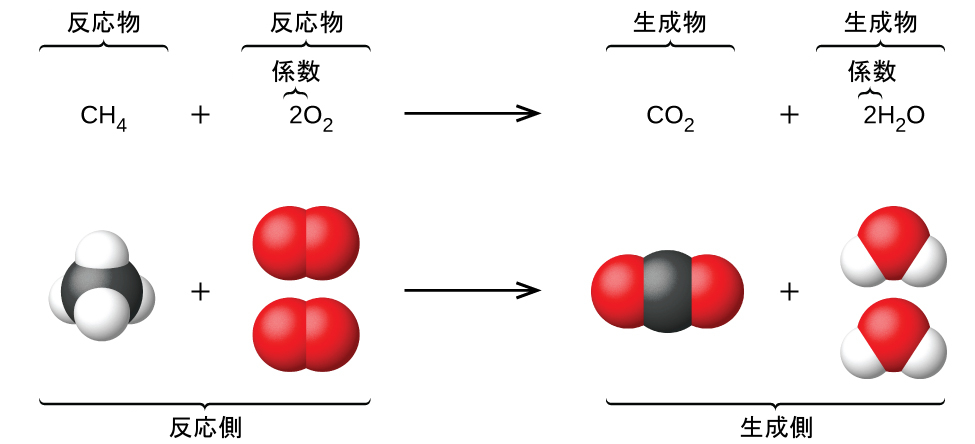
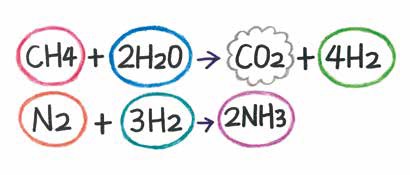
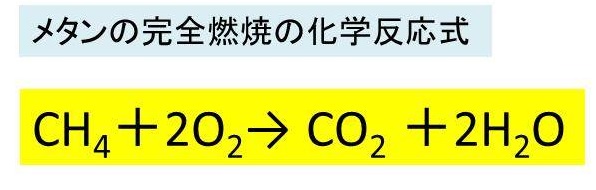
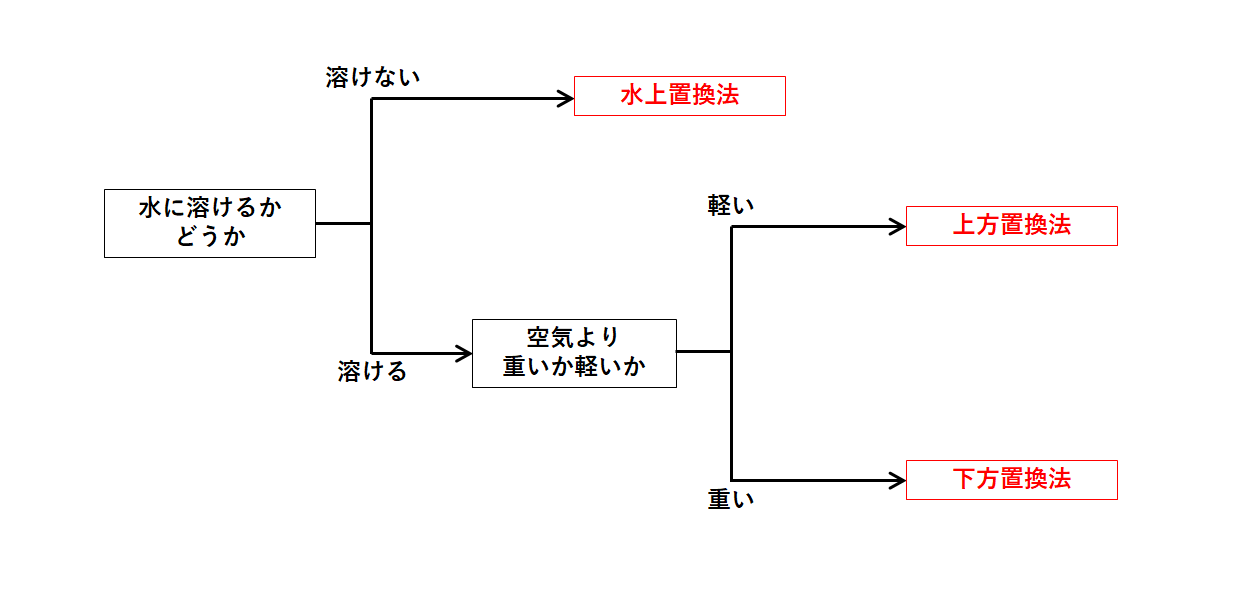
アンモニア 燃やす 化学式-②物質を化学式で表し、矢印の左側と右側の原子の個数を数える。 〔問2〕メタンが燃焼したときの化学変化について, に適当な化学式を入れ,化学反応式を完成させなさ 3」は,アンモニア分子2個の中に窒素原子と水素原子が6個ずつふくまれること また化学式を持ち出して恐縮であるが、アンモニアを用いてNOxを除去する反応は、下記のようなものである。 NH3 + NO + 1/4 O2 → N2 + 3/2 H2O この反応式が何を意味するかと言えば、処理すべき窒素酸化物(この場合はNO)と同量のアンモニア(NH3)が要ると言う
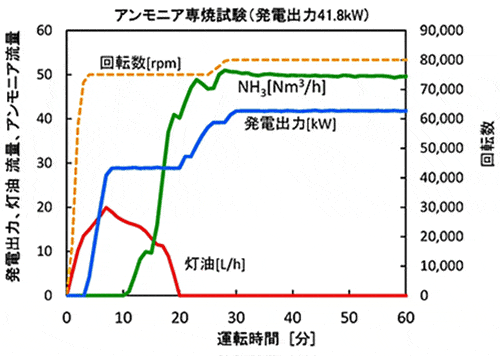
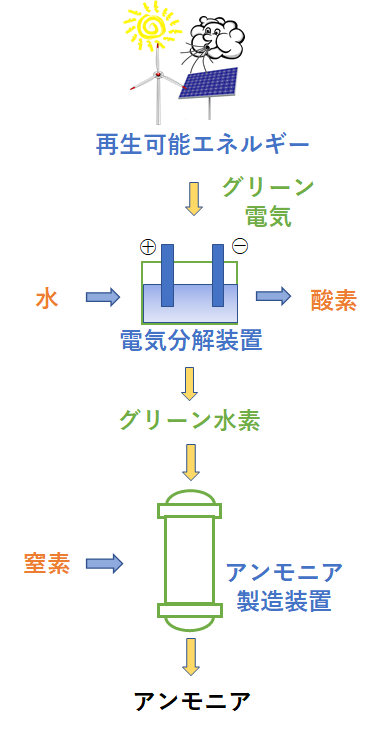
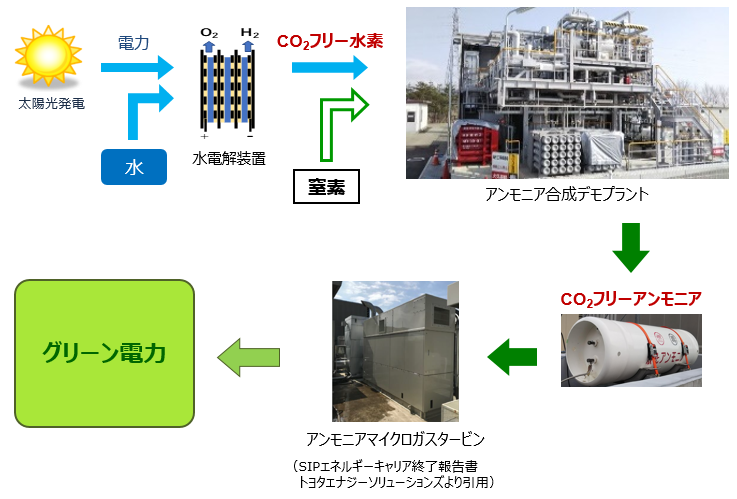
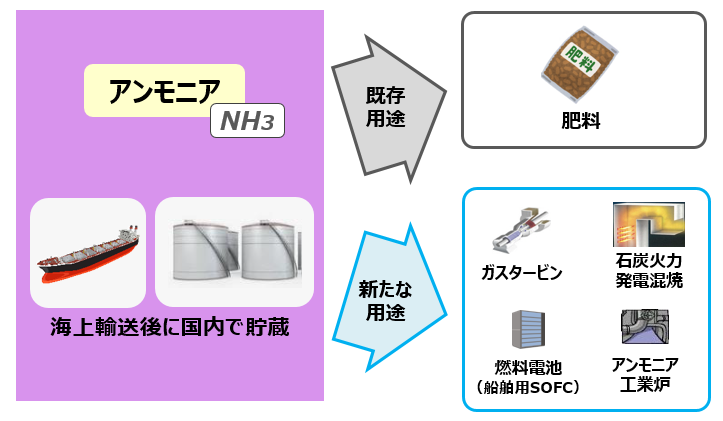
アンモニアを燃やして発電 環境エネルギー 事業成果 国立研究開発法人 科学技術振興機構
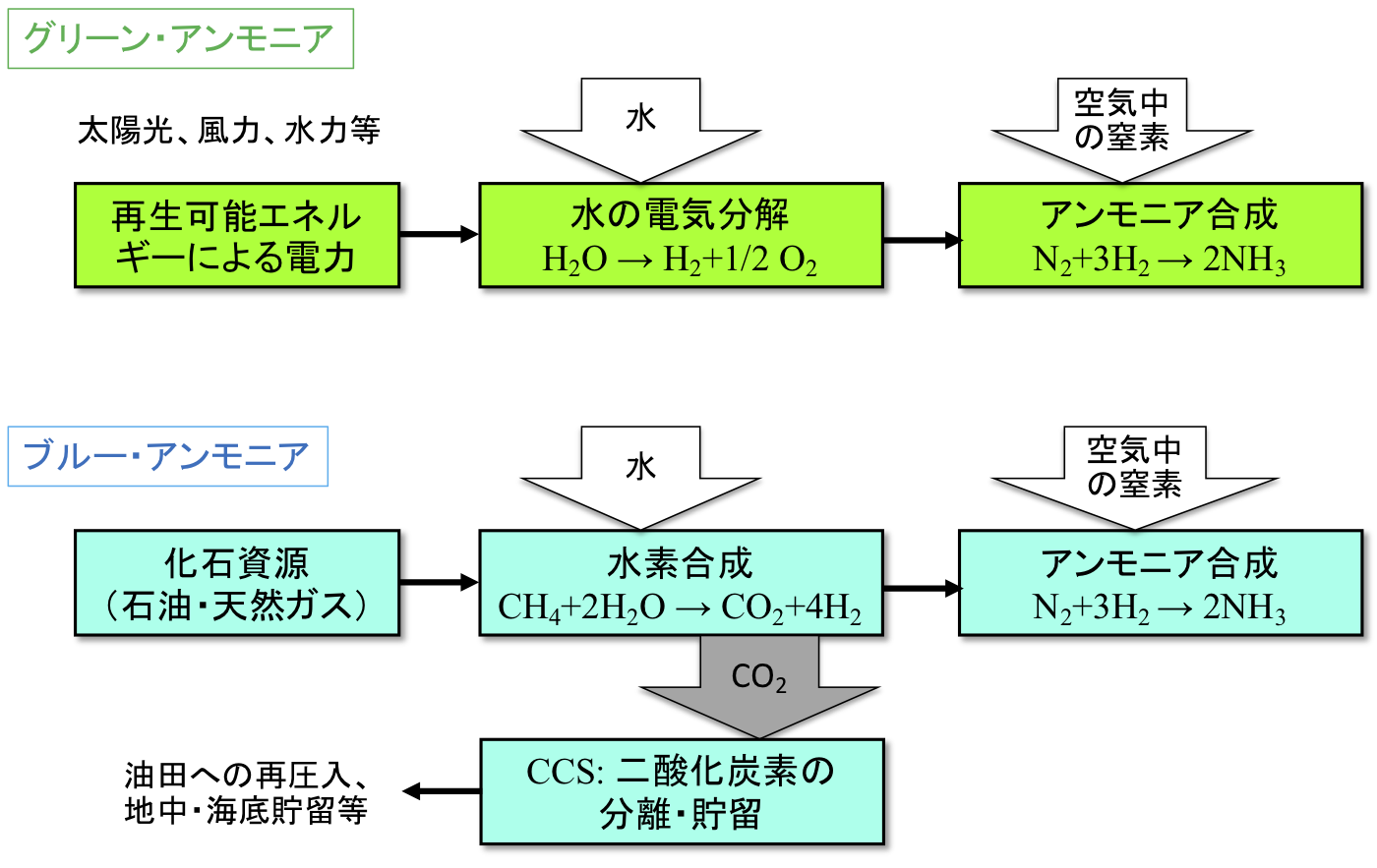
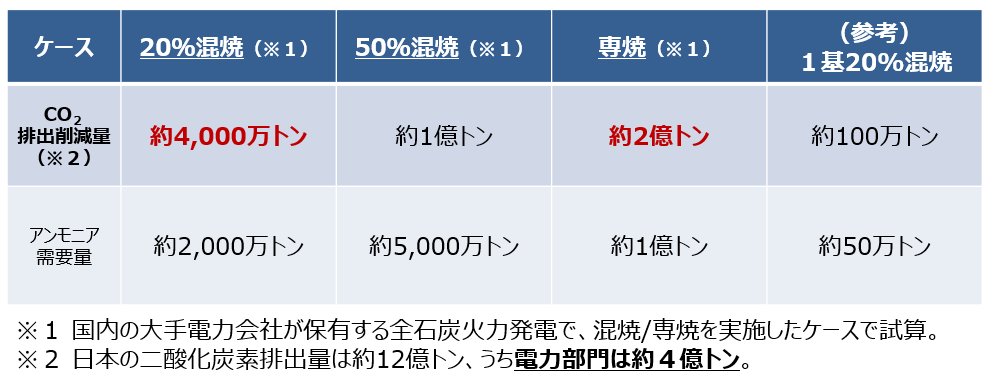
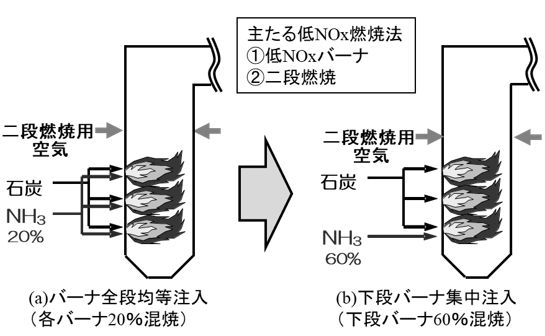
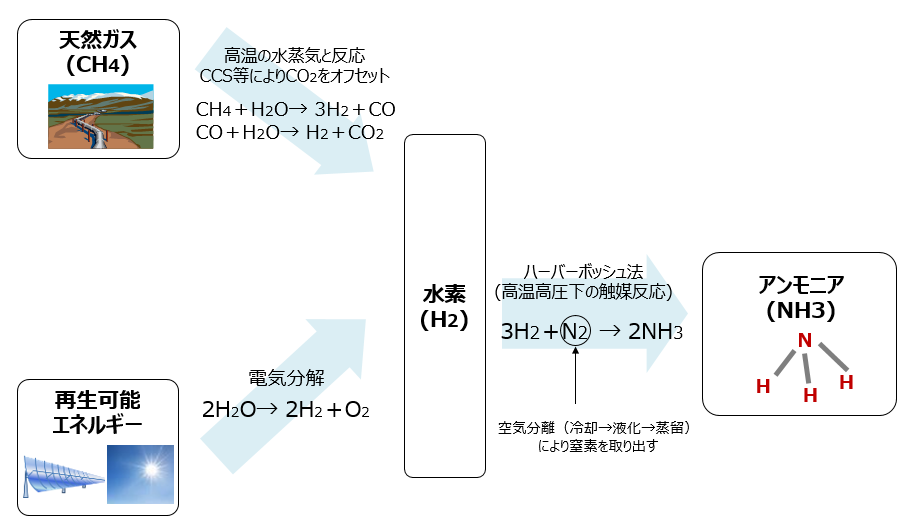
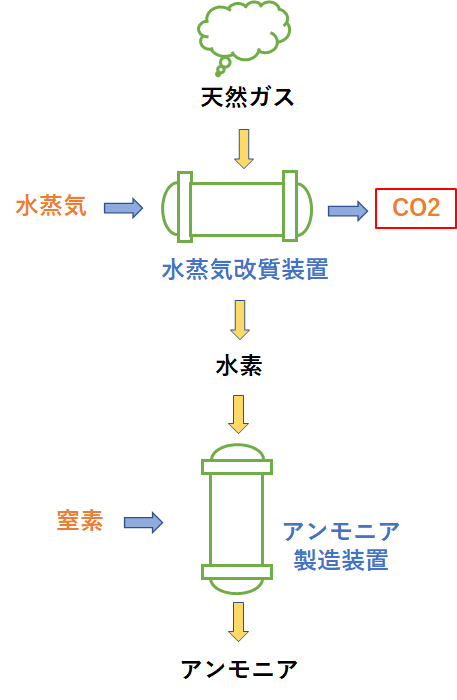
反応熱とヘスの法則 高温・高圧で H 2 と N 2 から NH 3 を生成する反応を考える。 アンモニアを生成する熱力学方程式は次のように書ける。 この反応式は、1 atm、 K における 2 mol のアンモニアを生成する方程式でもある。 この反応で、気体の物質量が科学技術振興機構(JST) 工業炉分野で化石燃料の代替燃料、アンモニアの社会実装に一歩近づく NOx の発生量を抑制する「アンモニア燃焼技術」を開発 大陽日酸株式会社、大阪大学大学院工学研究科教授の赤松史光らの研究グループは、アンモニア燃焼 やっていて虚しくならないのだろうか? さらに、アンモニアを燃やすことは 2)環境への悪影響に直結する。 アンモニアを燃やしたら、厄介な窒素酸化物 (NOx)が発生する。 NOxは酸性雨・オゾン層破壊・光化学スモッグ・PM25などの原因物質であり (N2Oは
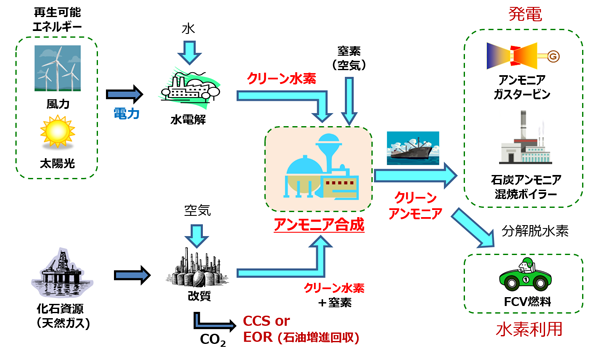
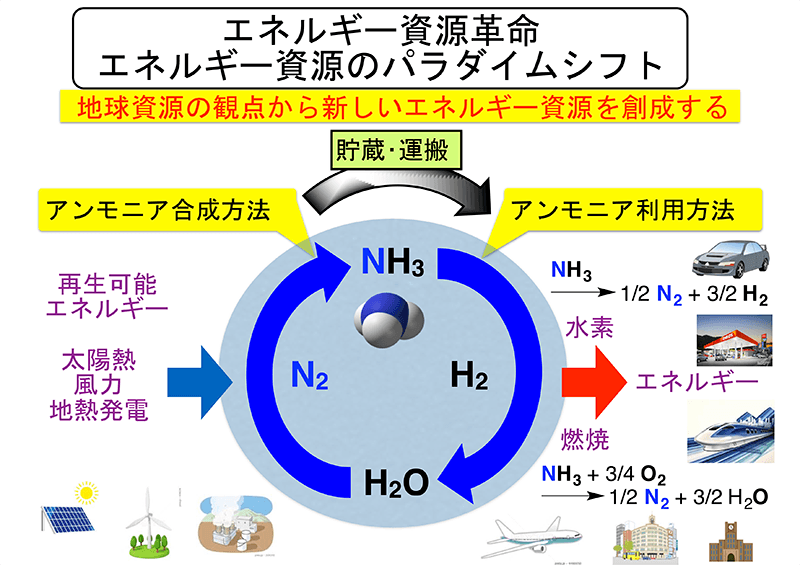
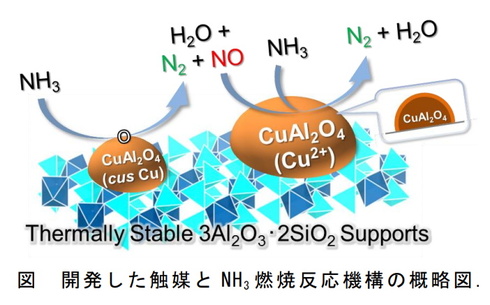
発熱型のnh3酸化分解(式2)に着目するとともに、触媒 の自発的な発熱により触媒層をアンモニア燃焼の開始温 度まで急速に加熱することでアンモニアの酸化分解を常温 から無加熱・瞬時に駆動可能な" 常温駆動プロセス"の 構築について検討した(図1)。アンモニア燃焼 エネルギーの製造・貯蔵輸送・利用におけるCO 2 排出を極限まで減らすために、エネルギーキャリアとしてアンモニアが有望視されています。 アンモニアは再生可能エネルギーで製造可能であり、高圧液化ガスとして常温で貯蔵輸送可能で都市ガスのみ 都市ガス +アンモニア ガスタービン燃焼器における火炎比較 火炎が長くなる • アンモニアは燃えるが、①燃焼性が低い、②燃料中窒素によるNOx(FuelNOx)の増加、 の課題がある • 液体アンモニア噴霧燃焼では、蒸発潜熱の影響により、より安定燃焼が難しくなると想定さ れるため、より効率的な燃焼ができる構造のバーナを開発した 3 液体アンモニア直接噴霧ガスタービンの研究
アンモニア 燃やす 化学式のギャラリー
各画像をクリックすると、ダウンロードまたは拡大表示できます
 | ||
 |  | |
 |  |  |
「アンモニア 燃やす 化学式」の画像ギャラリー、詳細は各画像をクリックしてください。
 |  | |
 |  | |
 |  | |
「アンモニア 燃やす 化学式」の画像ギャラリー、詳細は各画像をクリックしてください。
 | ||
 |  | |
 |  | |
「アンモニア 燃やす 化学式」の画像ギャラリー、詳細は各画像をクリックしてください。
 |  | |
 |  | 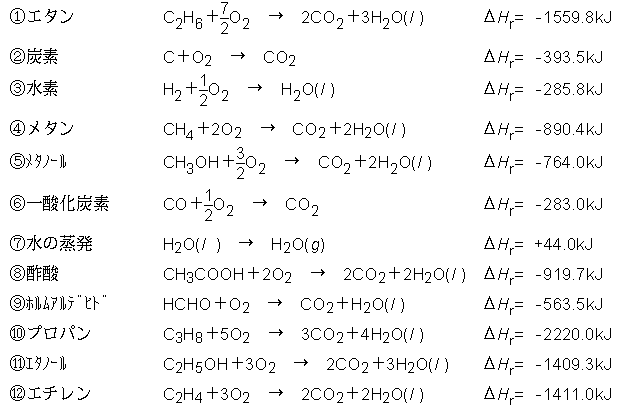 |
「アンモニア 燃やす 化学式」の画像ギャラリー、詳細は各画像をクリックしてください。
 | 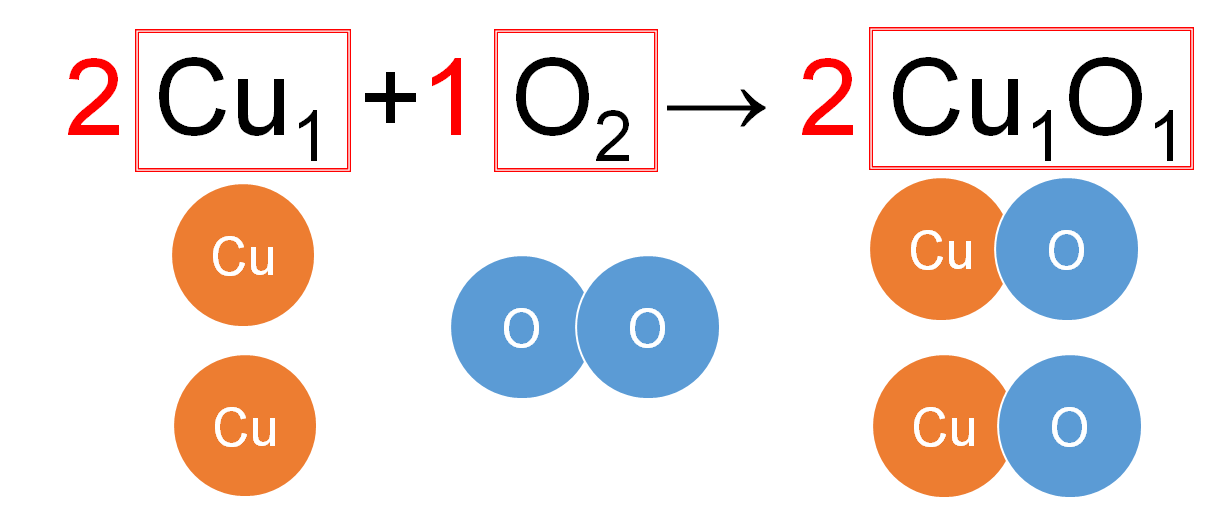 |  |
 |  |  |
 |  | |
「アンモニア 燃やす 化学式」の画像ギャラリー、詳細は各画像をクリックしてください。
 |  |  |
 |  | |
 |  | |
「アンモニア 燃やす 化学式」の画像ギャラリー、詳細は各画像をクリックしてください。
 |  |  |
 |  |  |
 |  | |
「アンモニア 燃やす 化学式」の画像ギャラリー、詳細は各画像をクリックしてください。
 | ||
 |  | |
 | ||
「アンモニア 燃やす 化学式」の画像ギャラリー、詳細は各画像をクリックしてください。
 |  | |
 |  |  |
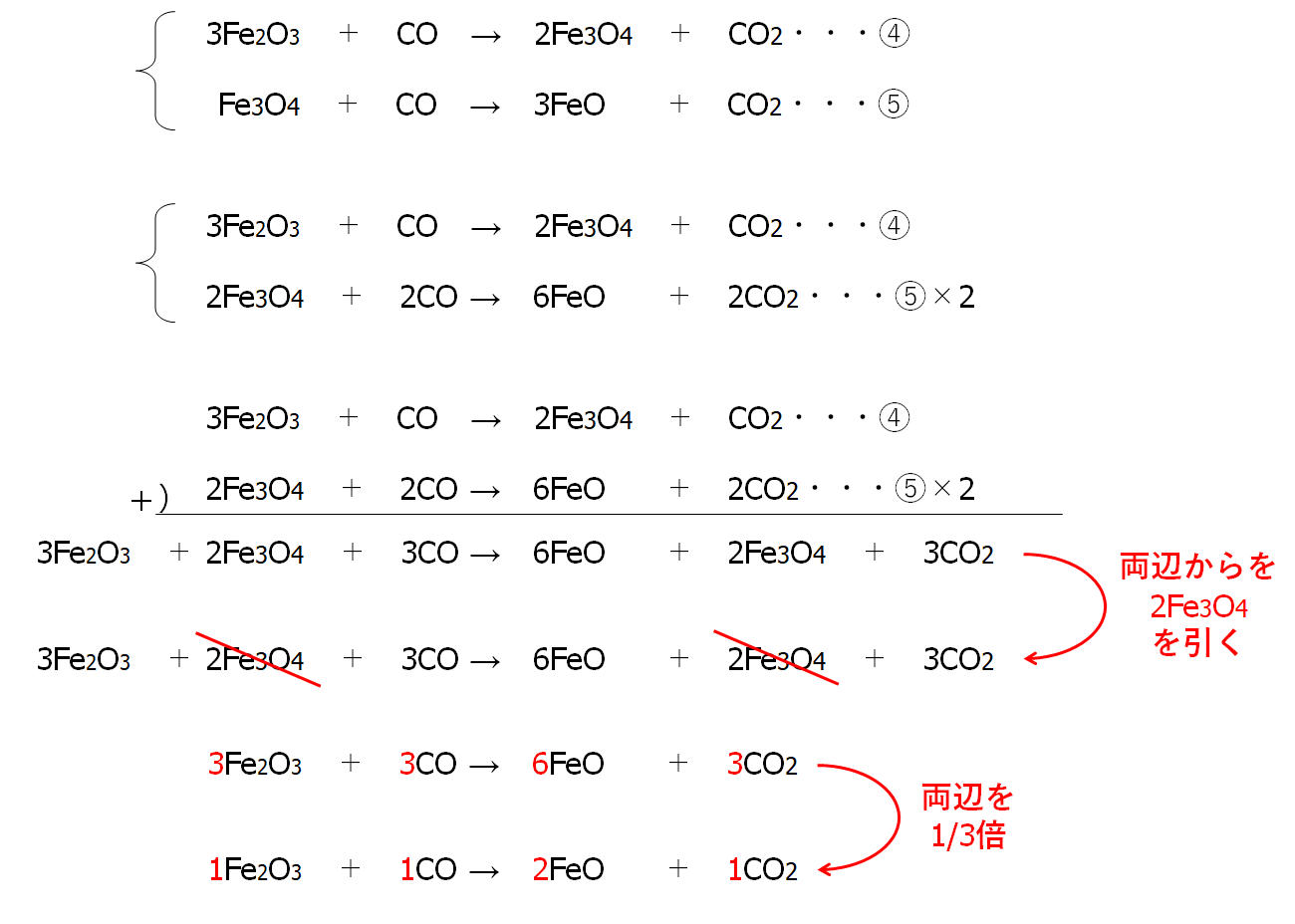 | ||
「アンモニア 燃やす 化学式」の画像ギャラリー、詳細は各画像をクリックしてください。
 |  | |
 |  | |
 |  |  |
「アンモニア 燃やす 化学式」の画像ギャラリー、詳細は各画像をクリックしてください。
 |  |  |
 |  | |
 |  |  |
「アンモニア 燃やす 化学式」の画像ギャラリー、詳細は各画像をクリックしてください。
 | 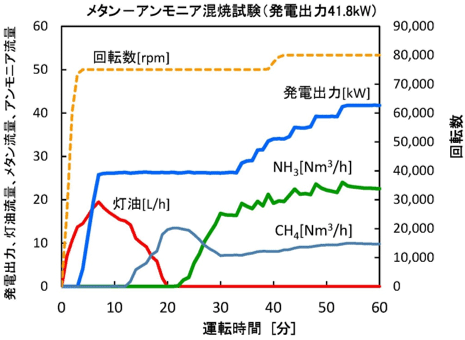 | |
 |
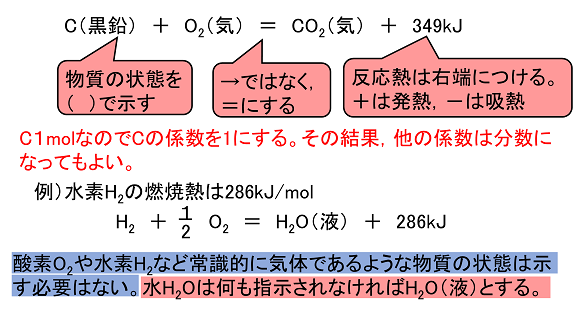
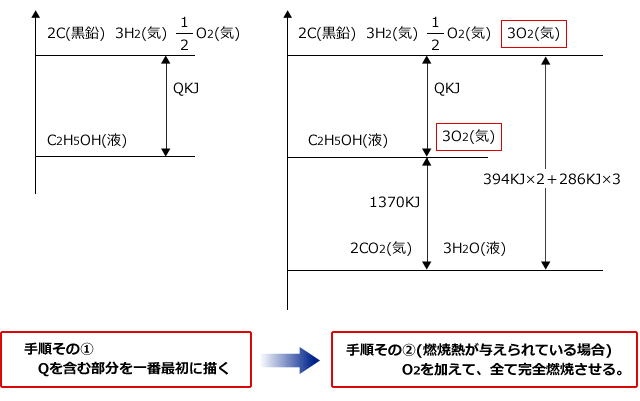
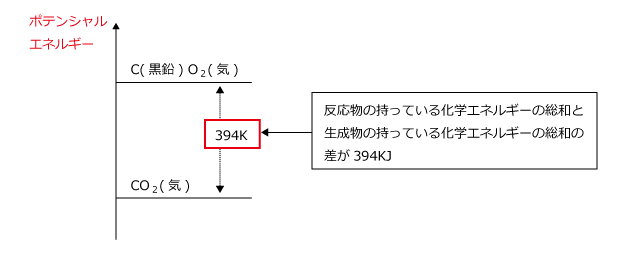
次の各反応熱を熱化学方程式で表せ。 (1) アンモニアの生成熱(46kj) (2)ブタンC4H10の燃焼熱(2878kj) (3)エタンC2H6の燃焼熱(エタン0.0molの燃焼熱で312kJの熱が発生)(4)塩化ナトリウムの溶解熱(39kj) この問題を解いてください。熱化学方程式のつくり方 1.化学反応式の「→」を「=」にする。 2.反応熱は常温常圧(25℃,1 気圧)での値を使い,方程式の右辺に記す。 このとき,発熱反応なら+の符号を,吸熱反応なら-の符号をつける。 3.物質の化学式の後に常温常圧(25℃,1
Incoming Term: アンモニア 燃やす 化学式,
コメント
コメントを投稿